产品搜索
结构搜索
全站搜索
当前位置: 行业资讯
清华赵凌云/过程所张贵锋/北化谢文升联袂ACS Nano:双离子纳米陷阱介导肿瘤细胞“双调亡”
本文转自x-mol
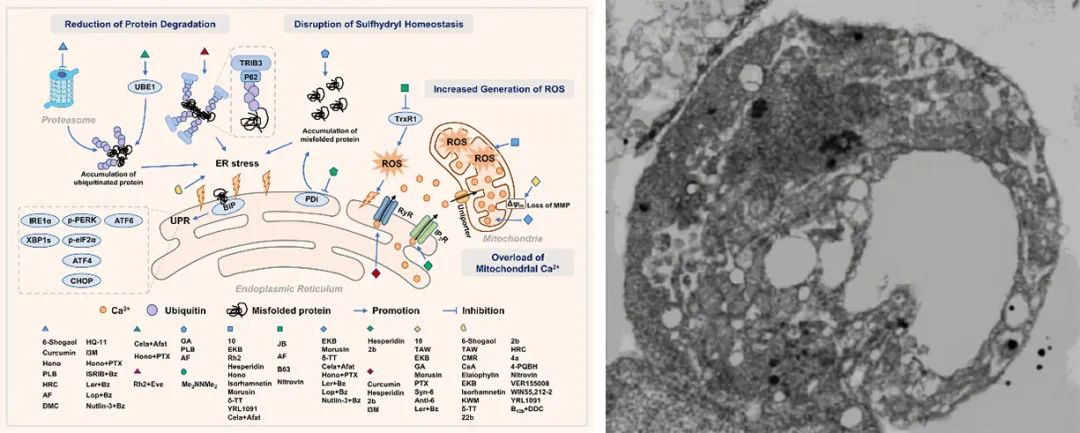
肿瘤细胞副凋亡(Paraptosis)
2000年,Sabina Sperandio等人报道了副凋亡(Paraptosis)(P Natl. Acad. Sci. USA 2000, 97 (26), 14376-14381)现象,它是细胞的一种程序性细胞死亡形式。在形态上与细胞凋亡和坏死不同,受蛋白稳态破坏或氧化还原和离子稳态改变影响,副凋亡细胞表现出广泛的细胞质空泡化,涉及内质网(ER)和/或线粒体(Mit)的肿胀。在肿瘤治疗中,传统治疗模式多通过诱导细胞发生凋亡来展现良好治疗效果,然而肿瘤细胞复杂的信号转导网络常常可以在靶点下游或旁侧介导各种补偿机制使其自身产生耐受性继而发生凋亡逃逸,从而导致后续肿瘤疾病的复发。因此,开发同时诱导细胞凋亡和副凋亡的有效药物不仅能克服与细胞凋亡相关的治疗耐药性,还能加强协同治疗效果。
双离子纳米陷阱同步诱导凋亡和副凋亡
近期,清华大学赵凌云副教授/中国科学院过程工程研究所张贵锋研究员/北京化工大学谢文升副教授等人阐释了负载双硫仑(DSF)的Ca2+/Cu2+双离子纳米陷阱同步诱导凋亡和副凋亡来增强乳腺癌治疗。具体机理如下:(1)颗粒降解释放Ca2+介导胞内离子稳态失衡导致钙过载,并引发线粒体中过氧化氢(H2O2)的过度表达。同时,与Ca2+/ROS相关的线粒体功能障碍会一定程度导致细胞副调亡发生。(2)释放的Cu2+和DSF代谢产物结合生成有毒CuETs 复合物可进一步诱导和加强细胞副调亡发生。(3)另外,释放出的Cu2+会被胞内谷胱甘肽(GSH)还原生成Fenton剂Cu+,后者可通过Cu+介导的类Fenton反应催化自供H2O2和胞内H2O2生成有毒羟自由基,从而诱导细胞凋亡。相关工作发表在ACS Nano,文章第一作者为中国科学院过程工程研究所博士后郭振虎。该研究得到了国家自然科学基金、博士后面上基金、国家重点研发计划、生化工程国家重点实验室等的支持。
这项研究主要验证了以下两个科学问题:一是首次尝试制备Ca2+/Cu2+双离子"纳米陷阱",通过同步诱导细胞凋亡和副凋亡,有效避免细胞凋亡逃逸。其次,DSF会在肿瘤细胞中原位代谢成二硫代氨基甲酸盐(DTC),与Cu2+形成有毒CuETs,因此纳米陷阱中的双硫仑起到了原药的作用,避免了对正常组织的不良影响。
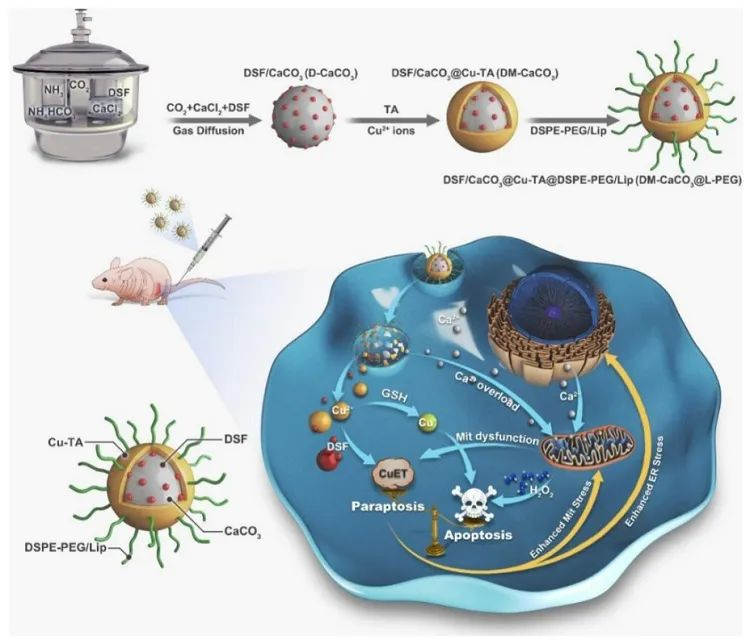
本研究提出了Ca2+/Cu2+双离子纳米陷阱的概念,并证实了其同步诱导癌细胞凋亡和副凋亡的可行性。在该纳米系统中,(1)无定形CaCO3可作为Ca2+的储存库,降解释放实现钙过载介导的Mit功能障碍,并增强H2O2产生。同时,Ca2+/ROS相关的Mit功能障碍会导致副凋亡细胞死亡。(2) 释放的Cu2+会被细胞内GSH还原生成Cu+,Cu+可通过类Fenton反应催化自供H2O2和胞内固有H2O2生成毒性羟自由基,从而诱导细胞凋亡。(3) 更重要的是,Cu2+与DSF的代谢产物DTC结合形成的毒性 CuETs复合物可进一步诱导和强化细胞副凋亡。
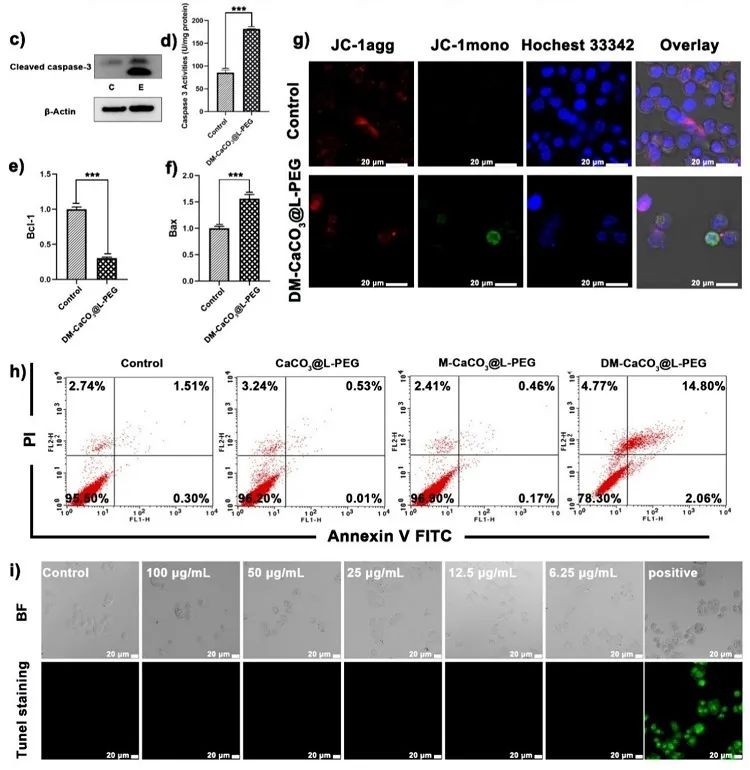
Ca2+/Cu2+双离子"纳米陷阱"诱导细胞凋亡
通过Western印迹和Caspase 3活性检测试剂盒对DM-CaCO3@L-PEG处理的细胞中凋亡相关蛋白Caspase 3的活性和表达进行了测定。与对照组相比,DM-CaCO3@L-PEG处理的细胞中Caspase 3的表达明显增加,表明细胞存在凋亡。定量反转录聚合酶链反应(RT-PCR)分析结果显示抑凋亡蛋白BCL-1实验组比对照组下调,促凋亡蛋白BAX实验组比对照组上调。同时,细胞内释放的Ca2+也会导致Ca2+超载,诱导Mit的破坏,从而引起IP3Rs的正反馈,诱导ER进一步释放Ca2+以改善Mit对Ca2+的摄取。在这项工作中,用JC-1染色法评估了4T1细胞经DM-CaCO3@L-PEG NPs培养后的线粒体膜电位,JC-1在线粒体膜电位高时呈红色荧光的JC-1聚集体,在线粒体膜电位低时呈绿色荧光的单体。与对照组相比,DM-CaCO3@L-PEG处理组的绿色荧光增加,表明线粒体膜电位降低,线粒体受损。此外,Annexin V-FITC和碘化丙啶(PI)双染色检测也显示DM-CaCO3@L-PEG NPs可诱导细胞凋亡。但有趣的是,DM-CaCO3@L-PEG组只有少数细胞(14.8%)出现晚期凋亡,大部分细胞保持正常状态,这与CCK-8分析结果相矛盾。同时,在所有实验组中,TUNEL染色的4T1细胞均未观察到明显的荧光信号。因此,我们推测DM-CaCO3@L-PEG诱导癌细胞死亡存在其他主要机制。
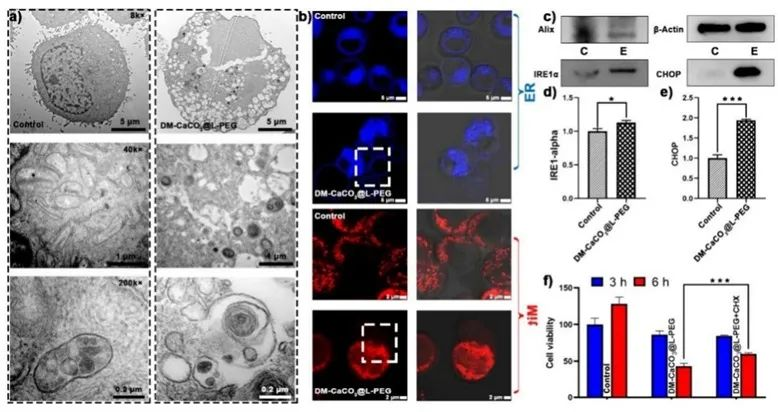
Ca2+/Cu2+双离子"纳米陷阱"诱导的细胞副凋亡
观察不同放大倍数处理细胞的透射电子显微镜图像,发现与对照组相比,DM-CaCO3@L-PEG培养细胞出现大量胞质空泡,Mit和ER也出现肿胀。这一证据表明细胞发生了副调亡。之前的一项研究证实,钙超载诱导的Mit功能障碍可导致癌细胞副调亡。此外,为进一步研究DM-CaCO3@L-PEG介导的形态变化,实验用Mitro-Tracker Red和ER-Tracker Blue对处理过的细胞进行了染色,结果在Mit表面和ER表面观察到了可视化气泡。随后,通过 Western印迹研究了DM-CaCO3@L-PEG介导的副调亡相关蛋白的表达。结果表明,DM-CaCO3@L-PEG NPs可降低副凋亡特征蛋白Alix蛋白的表达,从而激活肿瘤细胞的副凋亡。此外,ER应激相关蛋白包括IRE1α和CHOP也出现了大量的积累行为,这表明DM-CaCO3@L-PEG造成有效的ER应激。此外,还通过RT-PCR评估了IRE1α和CHOP的表达,结果显示这两种蛋白在DM-CaCO3@L-PEG处理的细胞中都有显著增加。作为一种副凋亡抑制剂,环己亚胺(CHX)可以抑制蛋白质合成,从而减少错误折叠蛋白的潜在负担和蛋白毒性,同时减少诱导细胞副凋亡死亡。在DM-CaCO3@L-PEG处理的4T1细胞中添加CHX 6小时后,细胞存活率得到提高,从而抑制了副凋亡发生。
这项研究为制备新型双离子干扰癌症治疗纳米材料提供了一种通用策略,提出通过“双凋亡(凋亡和副凋亡)”途径杀伤癌症的治疗思路,为更好理解凋亡和副调亡之间的作用关系以及开发相关药物提供了重要参考。












