产品搜索
结构搜索
全站搜索
当前位置: 专题聚焦
Sci Adv | 蒋若天/温祥毅揭示钾离子通道参与健康和衰老视网膜视觉信号调控新机制
本文转自:BioArt
视网膜神经节细胞(Retinal ganglion cell, RGC)不仅接收上级神经元的信号,还在信号进入大脑前,通过神经环路及离子通道等对视觉信息进行线性或非线性计算。尽管多种机制可以调节RGC的兴奋性及动作电位放电模式,但RGC兴奋性变化如何调控初级视觉环路,特别是如何对非线性视觉信号处理的分子机制和原理尚不完全清晰。
在光感受器细胞和双极细胞以及双极细胞和RGC的突触之间,神经元活动介导的胞外酸化(extracellular acidification)可将突触间隙的pH值从7.5降至6.9【1, 2】,并参与负反馈(negative feedback)信号的传导以及周围接收野(surround receptive field)的形成【3-6】,然而这种生理性的瞬时酸化是否对向前传到RGC的信号有正反馈(feedforward)效应?在RGC 上,AMPA受体、NMDA受体、酸敏感离子通道(acid-sensing ion channel,ASIC)等多种离子通道都具有酸敏感性【7-9】。然而,这些酸敏感通道只对病理性酸化(如pH<6.5)才会有显著的反应。
双孔钾离子通道(Two-pore-domain potassium channel,K2P)是一类四乙胺(Tetraethylammonium, TEA)非敏感性背景钾离子通道家族,不同亚类K2P对不同刺激敏感性不同,多种内源性和外源性的刺激可调控K2P通道激活,如:机械刺激 、多不饱和脂肪酸刺激 、酸度pH刺激等【10】。双孔酸敏感钾离子通道3 (Tandem pore domain acid-sensitive K channel 3 ,TASK-3) 是K2P众多亚家族中的一类。TASK-3在中枢和周围神经系统中均有表达,并参与调控睡眠、情绪、疼痛等【11-13】。作为酸敏感性K2P,TASK-3尤其对生理性pH变化范围(pH 7.5-6.5)敏感:胞外酸化可使其关闭、胞外碱化使其开放【14, 15】。故TASK-3或是RGC感知胞外生理性酸化、调节视觉信号潜在候选离子通道。
四川大学华西医院麻醉转化医学国家地方联合工程中心蒋若天研究员团队长期围绕离子通道参与感知觉神经环路调控/失调开展工作【13, 16, 17】。为验证TASK-3通道调控初级视觉神经环路这一科学假说,蒋若天研究员团队与四川大学华西医院眼科/眼视光学系展开合作,于2022年9月7日,在Science Advances杂志在线发表了题为Tandem pore domain acid-sensitive K channel 3 (TASK-3) regulates visual sensitivity in healthy and aging retina的研究论文,揭示了钾离子通道参与健康和衰老视网膜视觉信号调控新机制。

该研究发现了:(1) 双孔钾离子通道TASK-3在 RGC 中的显著表达,(2) 并通过感知神经元活动依赖性胞外酸化来调节 RGC 的兴奋性和光敏感性,(3) 从而调控瞳孔对光反射、视觉锐度、对比敏感度等非成像和成像功能。(4) 该研究还发现老年小鼠RGC中TASK-3 表达和功能降低;在 RGC 中特异性过表达TASK-3 可逆转衰老导致的视觉功能下降,将老年小鼠视力恢复到年轻小鼠水平。因此,该研究结果首次揭示了双孔钾离子通道在视网膜视觉信号处理中的新机制,并为减缓衰老过程中视觉功能的下降,提供了一个潜在的靶点与方法。
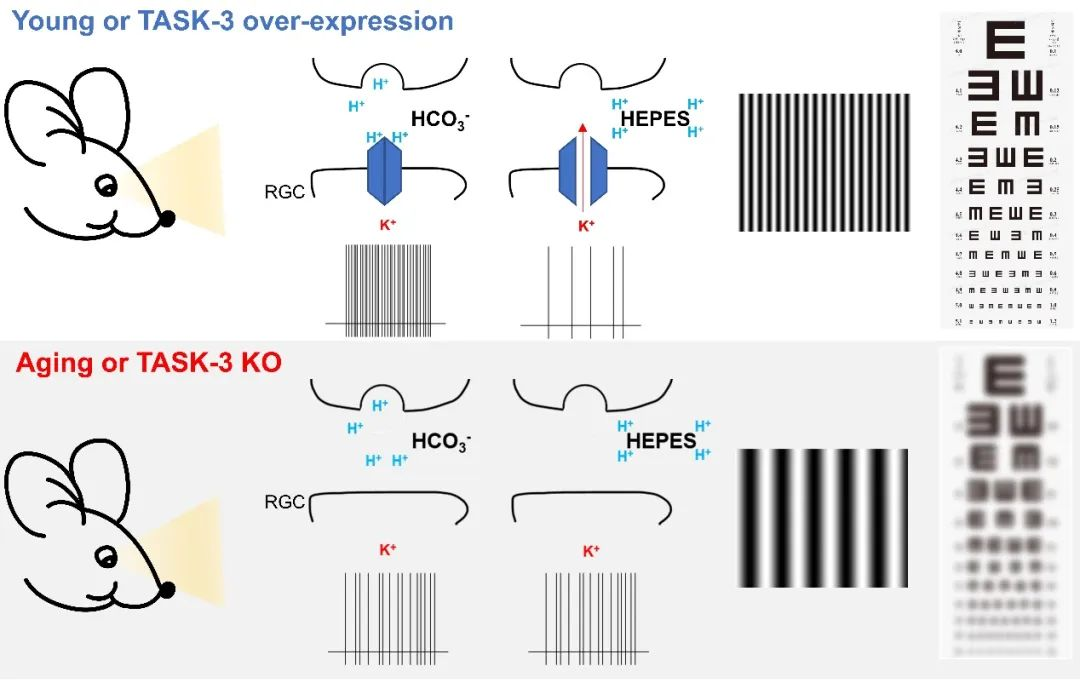
该研究发现至少96% 的RGC中均表达TASK-3,其中至少91%的自感光RGC(Intrinsically photosensitive RGC, ipRGC)也表达TASK-3。使用特异性抑制剂PK-THPP抑制TASK-3或基因敲除TASK-3能去极化静息膜电位、增大RGC输入电阻,从而能够显著提高RGC内在兴奋性。
强pH缓冲剂HEPES能够缓冲神经元活动介导的胞外瞬时酸化【1, 2】,而不影响整体外液的pH。该研究发现,HEPES能显著抑制暗适应后OFF RGC的自发放电频率;而当TASK-3被抑制或者敲除后,HEPES失去对OFF RGC的抑制效应。同样的,HEPES能显著抑制ON RGC强光诱发的动作电位,而对弱光和中等强度光诱发的动作电位影响则有限;当TASK-3被抑制或者敲除后,这种非线性光反应则减弱或消失。离体电生理实验结果提示TASK-3通过感知胞外神经元活动介导的酸化程度,增强RGC非线性信号传导,从而增强RGC对光反应的对比敏感度(contrast sensitivity)。
因此,在视觉行为学实验中,研究团队发现抑制或敲除TASK-3则会显著降低小鼠瞳孔对光反射(pupillary light reflex)敏感度、视力(visual acuity)、以及对比敏感度。通过运用腺相关病毒(adeno-associated virus,AAV)过表达系统,在TASK-3 基因敲除小鼠(TASK-3 KO)的RGC中特异性过表达TASK-3后,TASK-3介导的电生理特性、细胞兴奋性、pH敏感性、瞳孔对光反射敏感度、视觉锐度、以及对比敏感度均恢复到接近野生型小鼠(WT)水平。这些结果揭示了在RGC中,TASK-3通过感知胞外酸化程度,增强RGC信号输出的对比度与敏感性,从而进一步对维持成像和非成像视觉功能敏感性起着重要作用。
人类和小鼠的视力都随着年龄增长而下降【18, 19】。该研究发现老年小鼠RGC中TASK-3 的表达量只有年轻小鼠的一半,而RGC的细胞总数没有改变。鉴于观察到 TASK-3 在正常视网膜中的作用以及 TASK-3 在老年视网膜中的缺乏,该研究探索其过表达是否可以防止或减缓衰老过程中视觉功能的下降。研究团队在老年小鼠中使用了上述相同的AAV病毒过表达TASK-3策略,在老年小鼠RGC中特异性过表达TASK-3恢复了RGC的电生理特性、细胞兴奋性和pH敏感性,并且逆转了衰老过程中视力和对比敏感度的下降。因此,本研究也为逆转衰老过程中视觉功能的下降,提供了一个潜在的靶点与方法。
蒋若天研究员为该论文通讯作者,四川大学华西医院眼科/眼视光学系温祥毅博士为该论文第一作者;华东师范大学阳怀宇教授、四川大学华西医院实验师廖萍、硕士研究生罗运成、高级实验师杨玲慧参与了该工作;四川大学华西医院眼视光学系主任/眼科主任刘陇黔教授对该研究工作给与了大力支持与指导。












