产品搜索
结构搜索
全站搜索
当前位置: 专题聚焦
新型喹啉类光保护基促进蛋白质的高效合成
本文转自x-mol
自然化学连接(Native chemical ligation, NCL)是蛋白质化学合成领域里程碑式的工作,也是获取均一精确后修饰蛋白质的重要方法。NCL通过硫酯与半胱氨酸(Cys)进行选择性连接反应,实现多个多肽片段的组装,从而获得全长蛋白质。该方法也可用于表达蛋白质连接(EPL),通过连接反应将表达蛋白质与合成多肽片段进行连接的半合成策略。运用NCL构建后修饰蛋白质有两大核心问题:1)多肽C-端硫酯的制备;2)序列中Cys的丰度低(自然界丰度<1.7%,不能满足NCL的普适性需求)。清华大学刘磊课题组发展的多肽酰肼法,是多肽硫酯制备的重要进展。自由基脱硫反应及上海交通大学王平课题组发展的光催化硫代氨基酸合成方法(J. Am. Chem. Soc., 2020, 142, 14201, 点击阅读详细)解决了NCL受限于Cys位点局限性的问题,拓宽了NCL连接位点的选择范围。
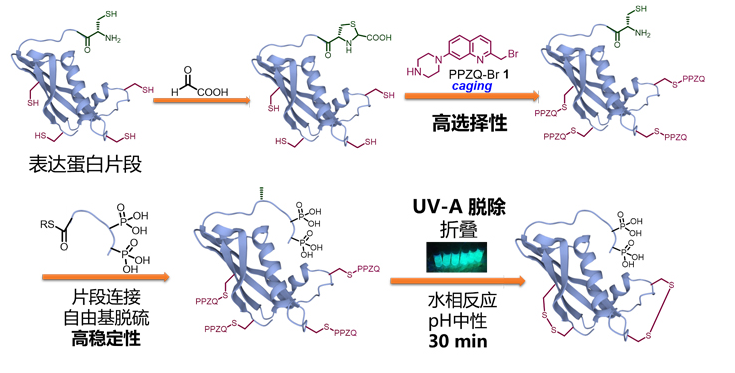
图1. 通过PPZQ正交保护对蛋白质进行半合成
表达蛋白连接(Expressed protein ligation, EPL)是蛋白质化学合成领域另外一项代表性的工作。然而,该方法依旧需要Cys的存在,并且难以与脱硫策略兼容。当全裸蛋白质中有其他天然Cys残基存在时,脱硫反应将没有选择性。因而,对Cys残基的正交保护策略就变得尤为重要,特别是在蛋白质半合成中,正交保护基必须满足如下条件:1)对全裸蛋白质上的多个Cys位点进行高选择高效率的全保护;2)耐受随后的NCL及自由基脱硫反应条件;3)可以在合成后期进行水相无痕脱除。由于蛋白质所处的化学环境非常复杂,能同时满足这些条件的正交保护基几乎没有,如传统的硝基苄光保护基中的硝基在自由基脱硫条件下可以被还原,因此其在蛋白质合成中的应用也受限。最近,上海交通大学化学化工学院王平(点击查看介绍)课题组发展了一种新型的喹啉类光保护基,解决了对天然Cys选择性保护/脱保护的难题。
在pH 7的水相溶液中,将表达蛋白质序列中的多个Cys巯基与小分子PPZQ-Br 1进行选择性取代反应,得到保护的蛋白质(图1)。同样在pH 7的水相溶液中,该保护基可以被快速光解脱除(λ = 365 nm)。作者将该策略应用于多步连续NCL和EPL半合成,并成功制备了蛋白质FAM240A、突触核蛋白γ及磷酸化胱抑素S。首先,作者通过模板肽2对PPZQ保护基的引入及脱除的反应条件进行筛选(图2)。实验表明,PPZQ-Br 1可以在水(0.2 M Na2HPO4)或6 M 盐酸胍(0.2 M Na2HPO4)的缓冲液 (pH 6.0-8.0)中对多肽巯基进行定量选择性保护,高效获得保护肽3。而保护肽3的脱除反应也非常高效,即在抗坏血酸钠(pH 7.0)或5-巯基苯乙酸(pH 3.0)中定量转化得到未保护肽2。随后,作者利用该条件验证了PPZQ对白细胞介素-34(IL-34)的保护/脱保护的高效性。如图2所示,IL-34片段4 (66-255)序列中含有6个半胱氨酸残基,在上述条件下,6个巯基都被PPZQ选择性地保护,并定量转化得到IL-34片段5。通过蛋白质组学鉴定表明,该蛋白质的其他亲核侧链如Lys的ε-胺及Tyr的苯酚残基等均不参与反应。在光解条件下,保护蛋白质5上的6个PPZQ光保护基也可以高效脱除,得到原蛋白质4。以上实验验证了PPZQ保护基在水相中引入或者脱除的高效性、高选择性。
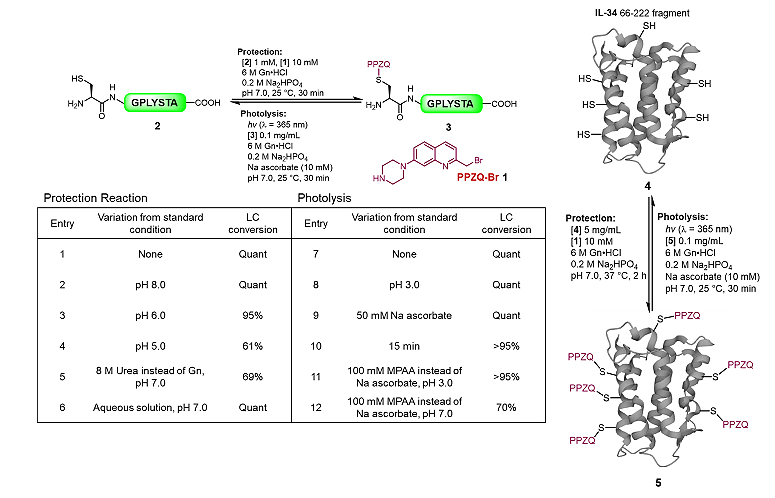
图2. 通过模板肽及蛋白质对PPZQ保护/脱保护条件进行筛选与验证
随后,作者通过模板蛋白质FAM240A 6的合成探究PPZQ光保护基的兼容性。如图3所示,作者通过NCL将多肽片段7和8进行连接,得到PPZQ保护的多肽片段9,随后脱硫得到PPZQ保护肽10。在MPAA及光照条件下,保护肽10经过光解反应得到脱保护肽11,所得反应液无需任何处理,随即直接与多肽片段12进行第二次NCL,即得到全长FAM240A蛋白6。FAM240A的合成验证了PPZQ可以完全兼容脱硫时的自由基还原条件。

图3. FAM240A蛋白质的合成。A)蛋白质FAM240A的序列与逆合成分析;B)蛋白质FAM240A的合成;C)脱硫后片段10的HPLC图谱;D)光解反应液的HPLC图谱;E)一锅法第二次NCL的反应液HPLC图谱;F)产物6的高分辨质谱。
鉴于光解脱保护反应无痕高效的特性,作者还通过突触核蛋白γ(SNCG)13的全合成展示了PPZQ光保护基在连续多步NCL反应中的应用。如图4所示,当多肽片段14和15通过NCL连接得到PPZQ保护的多肽16后,将反应液pH调至3.0并进行光照,即可得到PPZQ脱保护的产物17。随后调整反应液pH,并与片段18进行第二次NCL,得到PPZQ保护的多肽19,再经第二次光解脱保护得到多肽20,随后与片段21进行第三次NCL,得到全长蛋白质22,最后经脱硫即得到四片段一锅法连接的全长SNCG 13。脱硫反应前的连续反应之间完全不需要后处理或缓冲液交换,仅需调整pH值即可进行下一步光解或NCL反应。
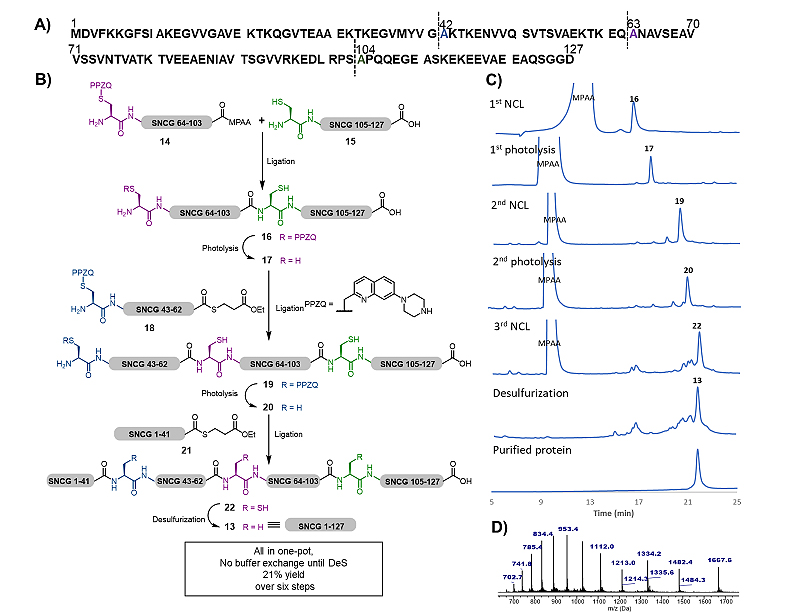
图4. SNCG蛋白质的合成。A)蛋白质SNCG的序列与逆合成分析;B)蛋白质FAM240A的合成;C)一锅法连续反应中的反应液HPLC图谱;D)产物13的质谱。
最后,作者将PPZQ保护策略应用于蛋白质半合成。胱抑素S(CST4)23是一种存在于人类唾液中的半胱氨酸蛋白酶抑制剂,具有重要的抗细菌抗病毒的活性。CST4的N端Ser1和Ser3均具有磷酸化修饰,而其四个Cys残基全部聚集在蛋白质C端,这样的序列特性使得EPL/脱硫策略的应用性极其受限。作者对该蛋白质进行巧妙的半合成(如图5A,5B)。首先经大肠杆菌表达获得较长的C-端蛋白质片段24,随后用乙醛酸保护N-端Cys残基形成Thz,再与PPZQ-Br反应以正交保护其他四个天然Cys残基,从而得到蛋白片段25(蛋白质组学实验验证了该正交保护的选择性)。随后,通过甲氧基胺盐酸对Thz上的乙醛酸进行脱除,即得正交保护的蛋白片段26即可与人工合成多肽片段27a(磷酸化)或27b(无磷酸化)进行NCL连接,得到全长蛋白质28a与28b。经分离纯化后,作者随即对蛋白质进行自由基脱硫,得到天然序列的全长蛋白质29a与29b。在光解后,所得还原蛋白质30a与30b在氧化还原条件下进行折叠复性,即得到人工合成的CST4蛋白23a(磷酸化)和23b(无磷酸化)。最后,作者通过抗木瓜酶水解实验对合成蛋白质进行生物活性测试。结果表明,市售CST4和无磷酸化合成蛋白23b的抗木瓜酶活性相似(IC50 分别为122 nM及111 nM),蛋白质组学分析及圆二色谱实验均证明了人工合成的CST4蛋白质折叠的正确性。实验还表明,磷酸化CST4 23a的活性(IC50= 33 nM)是无磷酸化23b的3倍。这个结论是可以解释的,即由于CST4的N端为半胱氨酸水解酶的结合域,磷酸化可以促进两者的结合,从而降低半胱氨酸水解酶的活性。
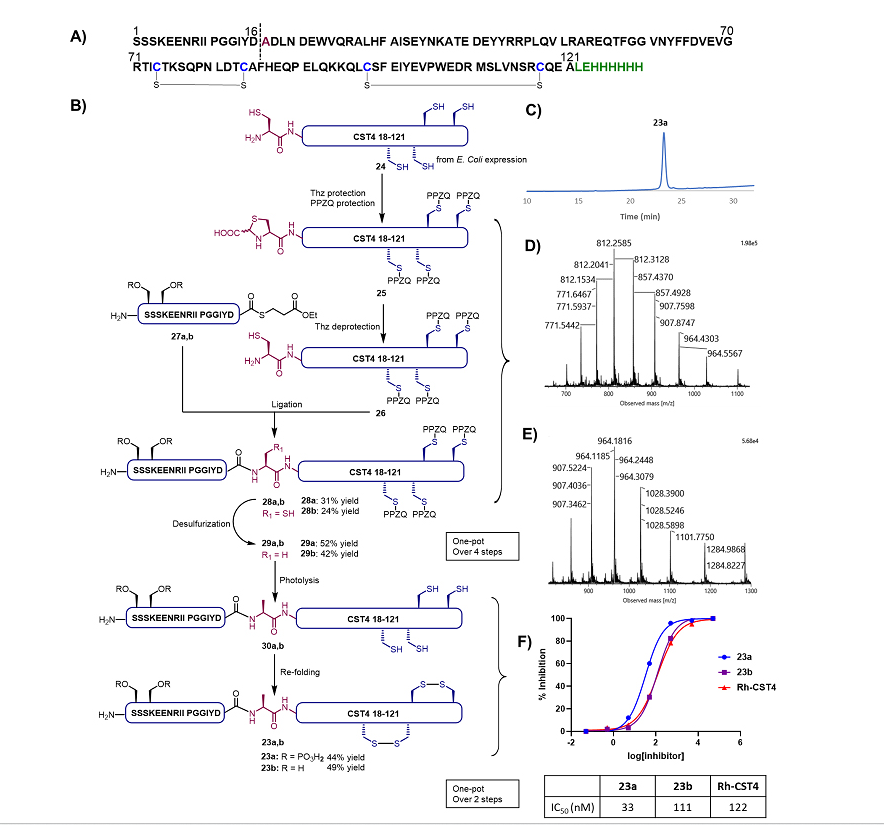
图5. CST4蛋白质的合成。A)蛋白质CST4的序列与逆合成分析;B)蛋白质CST4的合成;C)纯化后磷酸化CST4 23a的HPLC图谱;D)还原蛋白30a的高分辨质谱;E)折叠蛋白23a的高分辨质谱;F)合成CST4蛋白质23a和23b的抗木瓜酶活性测试。
利用该正交保护策略,作者高效合成了蛋白质FAM240A、突触核蛋白γ以及磷酸化胱抑素S蛋白质,该策略为蛋白质的半合成提供了重要的技术支撑。至此,王平团队通过前期对硫代、硒代氨基酸的高效制备和本工作的对天然Cys的选择性保护,解决了半胱氨酸在自然化学连接中的局限问题。该工作将在带有复杂修饰蛋白质的合成及结构改造中发挥核心作用。王平教授为本文通讯作者,并列一作王嗣尧博士、周清清博士毕业于悉尼大学,毕业后加入上海交通大学化学化工学院王平教授课题组。该项研究工作受到国家自然科学基金资助。












