产品搜索
结构搜索
全站搜索
当前位置: 行业资讯
Nature子刊 | 重庆大学罗忠/李孟桓开发新的纳米激动剂,可增强T细胞介导的抗肿瘤免疫反应
本文转自 iNature
cGAS-STING通路是一种关键的DNA传感机制,是克服实体瘤免疫抗性的有希望的靶点。2022年9月28日,重庆大学罗忠及李孟桓共同通讯在Nature Communications发表题为“A protein-based cGAS-STING nanoagonist enhances T cell-mediated anti-tumor immune responses”的研究论文,该研究报告了一种基于牛血清白蛋白(BSA)/铁蛋白的纳米激动剂,它结合了锰(II)离子和β-lapachone,它协同激活树突状细胞(DC)中的cGAS-STING信号传导,从而引发强大的适应性抗肿瘤免疫。总之,cGAS-STING纳米激动剂增强了肿瘤特异性T细胞介导的针对体内免疫原性较差的实体瘤的免疫反应,为临床免疫治疗提供了一种强有力的方法。

免疫疗法是一种很有前途的抗肿瘤方式,近年来引起了人们的极大兴趣,它是指能够刺激内源性免疫系统以引发抗肿瘤作用的广泛治疗类别。从机制的角度来看,免疫疗法的疗效主要依赖于肿瘤特异性效应T细胞的动员,在此期间,幼稚CD4+ T和CD8+ T细胞通过与抗原结合的II类和I类主要组织相容性复合物相互作用而被激活。MHC-II和MHC-I在抗原呈递细胞(APC)上表达。 然而,迄今为止,免疫疗法在实体瘤治疗中的应用一直具有挑战性,因为实体瘤可以在微环境中协调高度免疫抑制状态,以逃避T细胞介导的免疫消除。具体来说,肿瘤细胞可以通过抑制树突状细胞(DC)的成熟和活化来严重干扰抗原呈递过程,树突状细胞是人体中最有效的专业APC。由此产生的DC功能障碍将导致T细胞启动的严重失败并最终导致免疫耐受。因此,恢复和刺激DC功能已成为重振T细胞介导的抗肿瘤免疫的有希望的策略。环磷酸鸟苷-磷酸腺苷合酶(cGAS)-干扰素基因(STING)信号刺激物是人体内一种进化上保守的DNA感应机制,在调节肿瘤细胞和环境免疫细胞之间的串扰中起关键作用,表现为一个有希望的靶标,以提高免疫治疗对实体瘤的有效性。锰是人体必需的微量元素,其毒理学已广为人知,多种口服锰补充剂早已被批准用于预防或治疗与锰缺乏相关的疾病。从机制的角度来看,Mn2+ 可以直接与cGAS结合以增强其dsDNA敏感性和产生cGAMP的酶活性,从而即使在低水平的肿瘤来源dsDNA下也能刺激下游STING信号传导。另一方面,Mn2+ -cGAMP络合可以显着增强cGAMP的STING结合亲和力以促进STING活化,这比原始cGAMP高两个数量级。该研究报告了一种基于牛血清白蛋白(BSA)/铁蛋白的纳米激动剂,它结合了锰(II)离子和β-lapachone,它协同激活树突状细胞(DC)中的cGAS-STING信号传导,从而引发强大的适应性抗肿瘤免疫。Mn2+ -锚定甘露糖修饰的BSA和负载β-lapachone的铁蛋白交联以提供生物反应性蛋白质纳米组装体,其在酸性血管周围肿瘤微环境(TME)中解离成单分散的蛋白质单元,从而增强肿瘤穿透性和时空控制的Mn2+ 和β-lapachone分别递送至DCs和肿瘤细胞。β-lapachone引起免疫原性肿瘤细胞凋亡并将大量dsDNA释放到TME中,而Mn2+ 增强cGAS对dsDNA的敏感性并增强STING信号以触发下游免疫刺激信号。
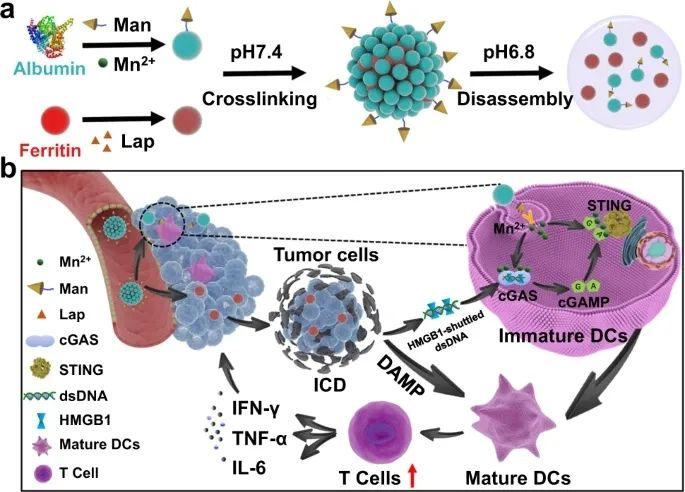
TME中基于蛋白质的纳米组装体的按需激活增强了免疫原性差的实体瘤的免疫反应(图源自Nature Communications )总之,该研究中基于蛋白质的cGAS-STING纳米激动剂的这些功能可以协同作用,以增强TME中DC介导的抗肿瘤效应T细胞的交叉启动,并改善低免疫原性肿瘤模型中的抗肿瘤免疫反应,从而提供在临床上增强免疫疗法对实体瘤适应症的疗效的新机会。












