产品搜索
结构搜索
全站搜索
当前位置: 行业资讯
陈素明课题组发展新型氮杂环丙烷化反应用于脂质异构体分析
本文转自X-MOL
脂质是细胞膜的主要成分,在生物体的能量储存和细胞信号传导中发挥着至关重要的作用。脂质结构的异质性赋予了其多样化的生物功能,尤其是丰富的脂质异构体。值得注意的是,不饱和脂质的C=C键位异构体比例与乳腺癌和脑缺血等多种疾病有显著相关性。此外,具有特定C=C键位置的不饱和脂质水平的变化可反映其独特的生物合成和代谢途径受到的干扰,这将提供病理机制的关键信息。
质谱是强大的定性与定量分析技术,而脂质双键位置异构质谱鉴定的难点在于难以得到双键位置处断裂的特征性碎片离子。因此,选择性的C=C键衍生与串联质谱的结合为鉴定脂质双键位置提供了很好的范例,而目前的主流方法是基于臭氧解反应、Paternò-Büchi 反应和环氧化反应形成的含氧杂环结构产物。烯的氮杂环丙烷化反应是合成氮丙啶结构的经典反应,通常是通过催化剂将氮卡宾转移到C=C键上。在2022年,武汉大学陈素明课题组提出利用氮杂环丙烷化反应,实现不饱和脂质C=C键的选择性衍生。该方法简便易操作,反应1分钟即可完成,生成的叔胺结构使衍生后的脂质具有极高的质子亲和力,从而大大提高了脂质异构体鉴定的灵敏度(BioRxiv 2022, DOI: 10.1101/2022.04.24.489320)。他们还发现,以[(N-对甲苯磺酰亚胺)碘]苯(PhI=NTs)为氮卡宾前体,Ir[dF(CF3)ppy]2(dtbbpy)PF6为光催化剂,也可通过光催化反应实现N-对甲苯磺酰基氮丙啶化衍生。基于这种可见光激发的氮杂环丙烷化反应,所形成的不饱和脂质氮丙啶环结构不仅可用于确定 C=C 键的位置,而且在与 LC-MS/MS 结合使用时还能提高sn-位置异构体的分离度。这一策略实现了对脂质中C=C键位置和sn-位置异构体的双重解析(Chin. Chem. Lett. 2023, 35, 108775)。
然而,对于双键异构体的精确定量分析,目前的方法仍主要局限于利用衍生物的特征片段来确定异构体比例。对不同样品之间的特定C=C键异构体进行精确定量非常具有挑战性,因为特定样品的基质效应会对脂质的离子化效率产生很大影响。如果有一种化学方法既可以对C=C键位置异构体进行定性鉴定,又可以对其进行准确、高灵敏的相对定量,这将为不饱和脂质的生物功能研究提供极大的便利。
稳定同位素标记(如还原二甲基化)已被证明是一种强大的基于质谱的定量方法,可准确定量不同样本之间的蛋白质表达差异。通过比较从完整质谱图中提取的重标记(氚标记)和轻标记(常规标记)肽段的离子色谱峰面积,可以准确定量蛋白质的相对丰度,因为标记的样品合并分析消除了基质效应差异。虽然同位素标记策略因其方便性和成本低廉而备受青睐,但其在脂质异构体定量中的应用却明显滞后。
近日,武汉大学陈素明课题组开发了一种便捷的双功能策略,能够一步实现定性鉴定和准确相对定量脂质C=C键异构体(图1)。他们开发了一种直接对不饱和脂质中的C=C键进行N-甲基氮杂环丙烷化反应的方法。一方面,在原C=C键位置形成的具有三元氮丙啶环的衍生化产物可以通过碰撞诱导解离(CID)获得特定位点的碎片,从而定位脂质中的双键。更重要的是,利用常规和合成的氚代N-甲基试剂可对不饱和脂质异构体进行轻重同位素标记,并进一步精确相对定量。此外,所形成的叔胺结构具有较高的质子亲和力,可大大提高电离效率较低的不饱和脂质的定性和定量灵敏度。这种双功能一步衍生策略可同时鉴定和定量脂质的C=C键异构体。
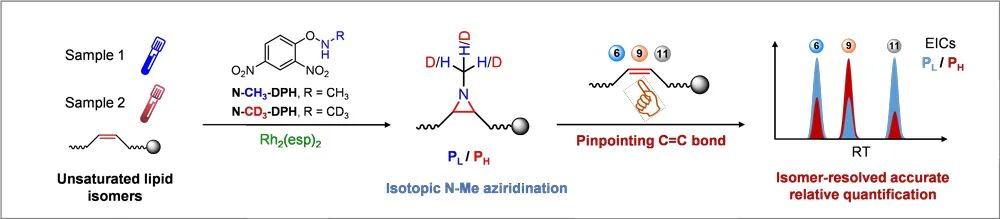
图1. 直接同位素 N-甲基氮杂环丙烷化法同时鉴定和准确相对定量不饱和脂质异构体。
他们首先利用探针N-methyl-O-(2,4-dinitrophenyl)hydroxylamine(N-Me-DPH)和不饱和磷脂酰胆碱(PC 34:1 | 16:0/18:1 (9Z)),通过自己发展的基于θ-毛细管的纳升静电喷雾离子化(nESTASI)质谱研究这种氮杂环丙烷化反应。虽然之前的研究通过计算化学方法推测了在 Rh2(esp)2 催化下 N-Me-DPH 与烯烃的氮杂环丙烷化反应机理(图2)。然而,铑-氮卡宾中间体的存在尚未得到直接验证。他们发现,在 m/z 788.1150处确实检测到了铑-氮卡宾中间体 2(C33H44O8NRh2)。更重要的是,在 m/z 1547.6996处还检测到了进一步的双自由基三元中间体 3。有趣的是,还观察到了 Rh-NCH3-Rh 配位中间体[4-NCH3-4]的形成。活性中间体的首次捕获为这种 Rh 催化反应机制提供了直接证据。

图2. 在 Rh2(esp)2 催化下 N-Me-DPH 与 PC 34:1 反应的验证。
不饱和脂质中C=C键的化学活化可使其在 CID 过程中更容易断裂,从而产生显示双键位置的特征碎片。在本研究中,他们全面考察了 N-甲基氮杂环丙烷化衍生在鉴定不饱和脂质双键位置方面的能力(图3)。
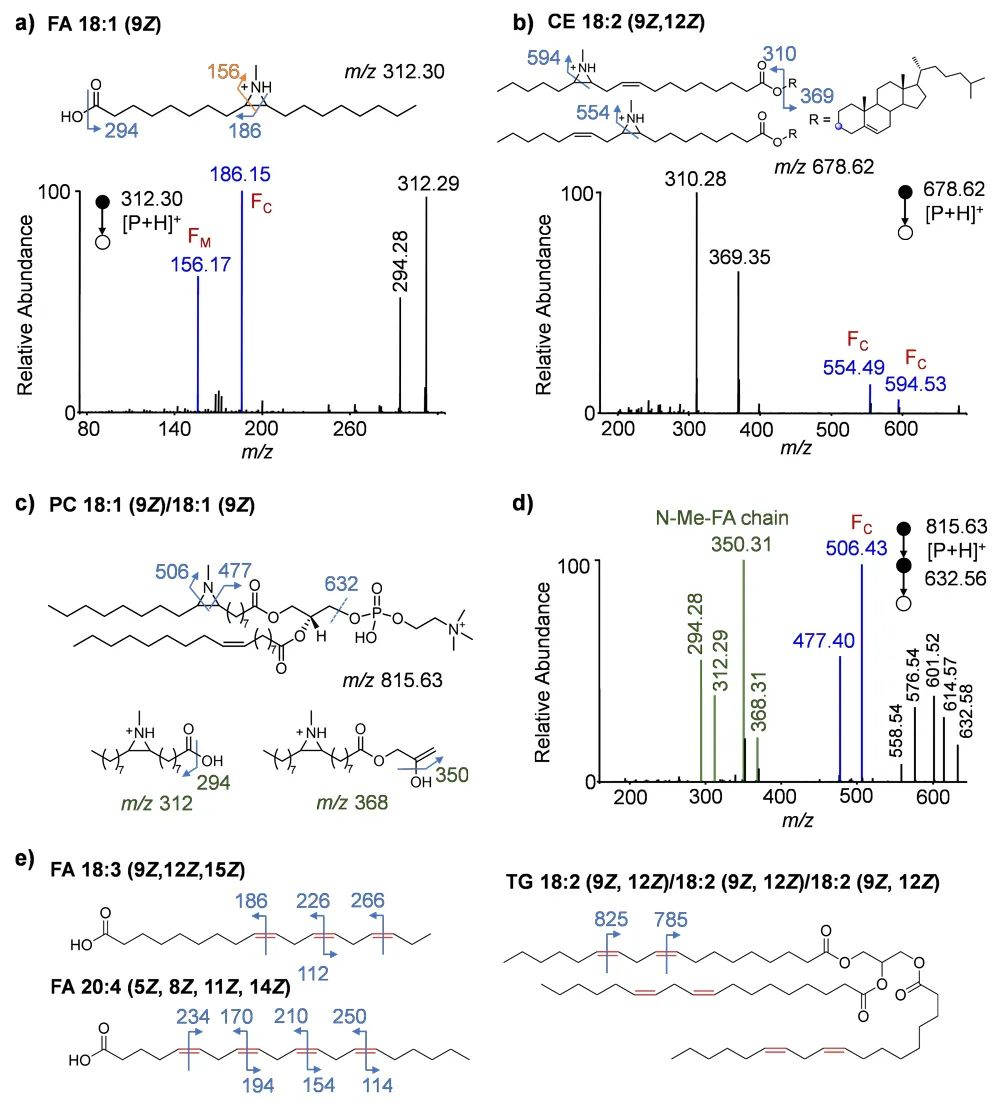
图3. 通过氮杂环丙烷化反应和质谱检测鉴定脂质中 C=C 键的位置。
在传统的脂质组学工作流程中,液相色谱-质谱(LC-MS)通常每次只会分析一个样品,而定量的准确性会受到不同样本间基质效应的影响。在证明了 N-甲基氮杂环丙烷化衍生方法在不饱和脂质中的定性能力后,他们认为引入1-甲基氮丙啶也提供了同位素标记定量的契机。以 N-Me-DPH 和氚代 N-CD3-DPH 作为胺化试剂,可分别实现轻标和重标,从而实现对不饱和脂质异构体的同时定性和相对定量。基于这一概念,他们建立了一个稳定同位素 N-Me标记工作流程,用于定性和定量分析C=C键脂质异构体(图4)。在该工作流程中,探针(包括 N-CH3-DPH 和 N-CD3-DPH)分别用于标记不同样品 1 和 2 中的不饱和脂质。然后,将反应溶液混合并进行 LC-MSn 分析。一步式稳定同位素标记将 N-CH3 和 N-CD3 标记到每个脂质中的一个 C=C 键上,3 Da 的质量差使串联质谱能够对每个样品中的脂质进行单独鉴定。因此,可以根据氮杂环丙烷化产物的特征片段,在 C=C 异构体水平上对脂质进行定量。
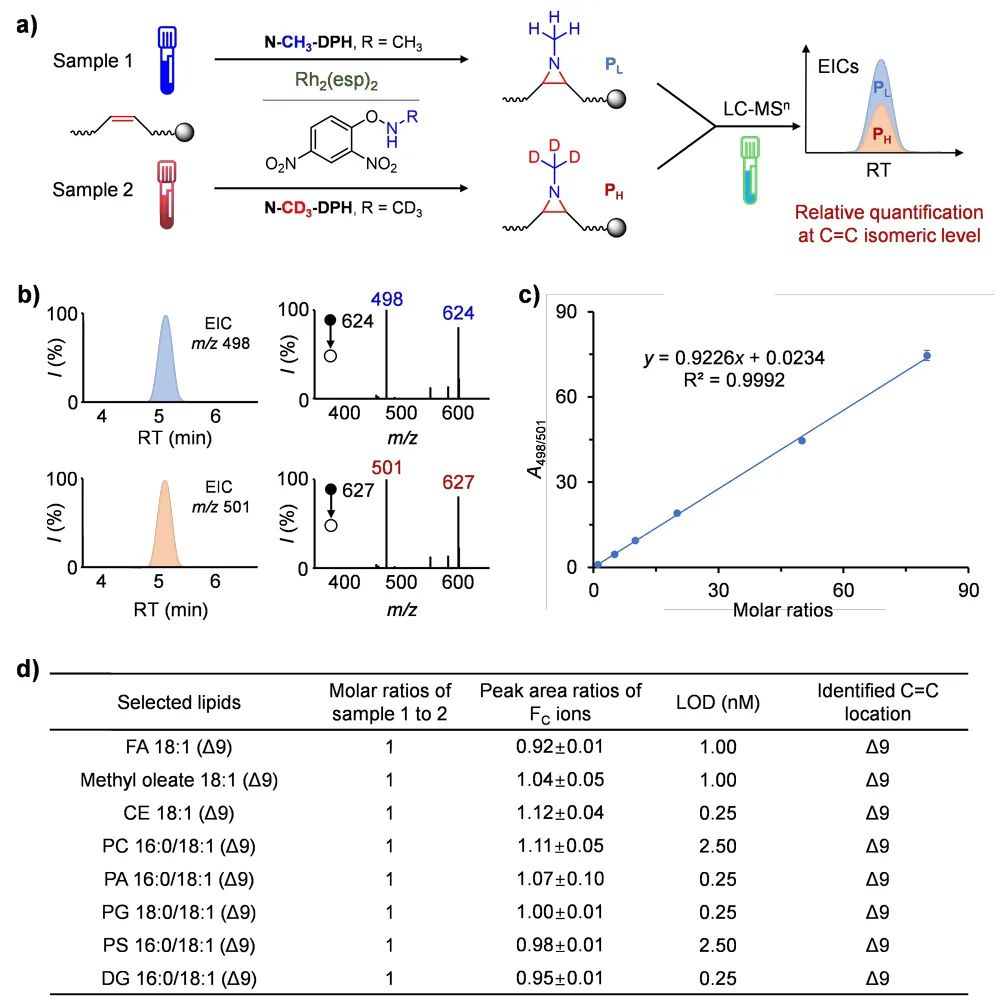
图4. 通过稳定同位素 N-Me 标记对不饱和脂质进行相对定量。
为了检验该方法在复杂生物样本中进行大规模脂质鉴定的潜力,他们以人血清为模型样本,建立了结构脂质组学分析的完整工作流程(图5)。首先,提取血清样本中的脂质并进行 LC-MS/MS 分析。利用 MS-DIAL 软件和 LipidBlast 数据库分析数据,生成包含部分脂质亚类和脂肪酰基链组成结构信息的脂质列表。然后,在此初步脂质列表的基础上,创建了另一个质量增加 30 Da 的扩展列表,用于对氮杂环丙烷化衍生脂质进行靶向脂质组分析。他们在扩展列表中添加了更多理论上存在但衍生化前未检测到的血清脂质,因为氮杂环丙烷化衍生化可提高脂质检测的灵敏度和覆盖度。与此同时,对另一份脂质提取物进行了 N-Me-DPH 氮杂环丙烷化衍生处理。然后使用扩展脂质列表,以靶向模式对衍生脂质进行 LC-MS2 或 LC-MS3(仅针对甘油磷脂)分析。最后,血清中的脂质被鉴定出明确的亚类、脂肪酰基链和 C=C 键的位置。通过开发的这一工作流程,在血清中鉴定出 551 种脂类,包括 39 种饱和脂类和 468 种在 C=C 位置水平上鉴定出的脂类。其中,检测到 136 对单不饱和与 7 对多不饱和 C=C 位异构体。如此大规模地鉴定血清脂质异构体,凸显了所开发的 N-Me氮杂环丙烷化衍生方法在提高脂质异构体鉴定灵敏度和覆盖度方面的优势。

图5. 血清中不饱和脂质的分析
在确认了稳定同位素 N-Me 氮杂环丙烷化标记的定性和定量能力后,下一步就是验证其在疾病模型中的适用性。因此,他们首先建立了大脑中动脉闭塞(MCAO)小鼠局灶性缺血模型。然后通过稳定同位素 N-Me 氮杂环丙烷化标记和 LC-MS 分析鉴定和量化了小鼠脑组织中不同类别的脂质 C=C 位置异构体。旨在通过定量比较正常脑半球和缺血脑半球中不饱和脂质异构体在C=C键位置水平上的含量差异,深入了解脑缺血期间的脂质代谢情况。
他们首先比较了等量小鼠脑组织中24种脂质异构体的含量比,这相当于轻标记(N-CH3-DPH)和重标记(N-CD3-DPH)产物分别产生的诊断离子的峰面积比,从而评估了相对定量的准确性(图6a)。其中,23 种脂质异构体比例的相对标准偏差在 ± 10% 以内,只有一种脂质异构体的相对标准偏差达到 13%。结果表明,这种稳定同位素 N-Me 氮杂环丙烷化标记方法可以实现精确的相对定量分析。然后,他们比较了再灌注 1 天和 3 天后正常脑组织(左侧,轻标记)和缺血脑组织(右侧,重标记)中脂质位置异构体的相对丰度。在正常脑组织和缺血脑组织中确实观察到几种不饱和脂质存在显著差异(图6b-6e),包括 PC 16:0_18:1(Δ9)、PC 16:0_18:1(Δ11)、PE 16:0_18:1(Δ11)、DG 18:0_18:1(Δ11)、TG 14:0_16:0_18:1(Δ9)、TG 14:0_16:0_18:1(Δ11)、TG 16:0_16:0_18:1(Δ9)和 TG 16:0_16:0_18:1(Δ11)。有趣的是,与正常半球相比,缺血部分的磷脂 PC 16:0_18:1 (Δ9) 、PC 16:0_18:1 (Δ11) 和 PE 16:0_18:1 (Δ11) 的丰度在再灌注 1 或 3 天后显著增加。然而,在缺血期间观察到一些甘油三酯明显减少,包括 DG 18:0_18:1 (Δ11), TG 14:0_16:0_18:1 (Δ9), TG 14:0_16:0_18:1 (Δ11), TG 16:0_18:0_18:1 (Δ9) 和 TG 18:0_18:0_18:1 (Δ11)。这种同位素氮杂环丙烷化标记方法不仅能确定脂质异构体的双键位置,还能对其进行准确的相对定量,这将为研究特定C=C位置的不饱和脂质异构体带来极大的便利。
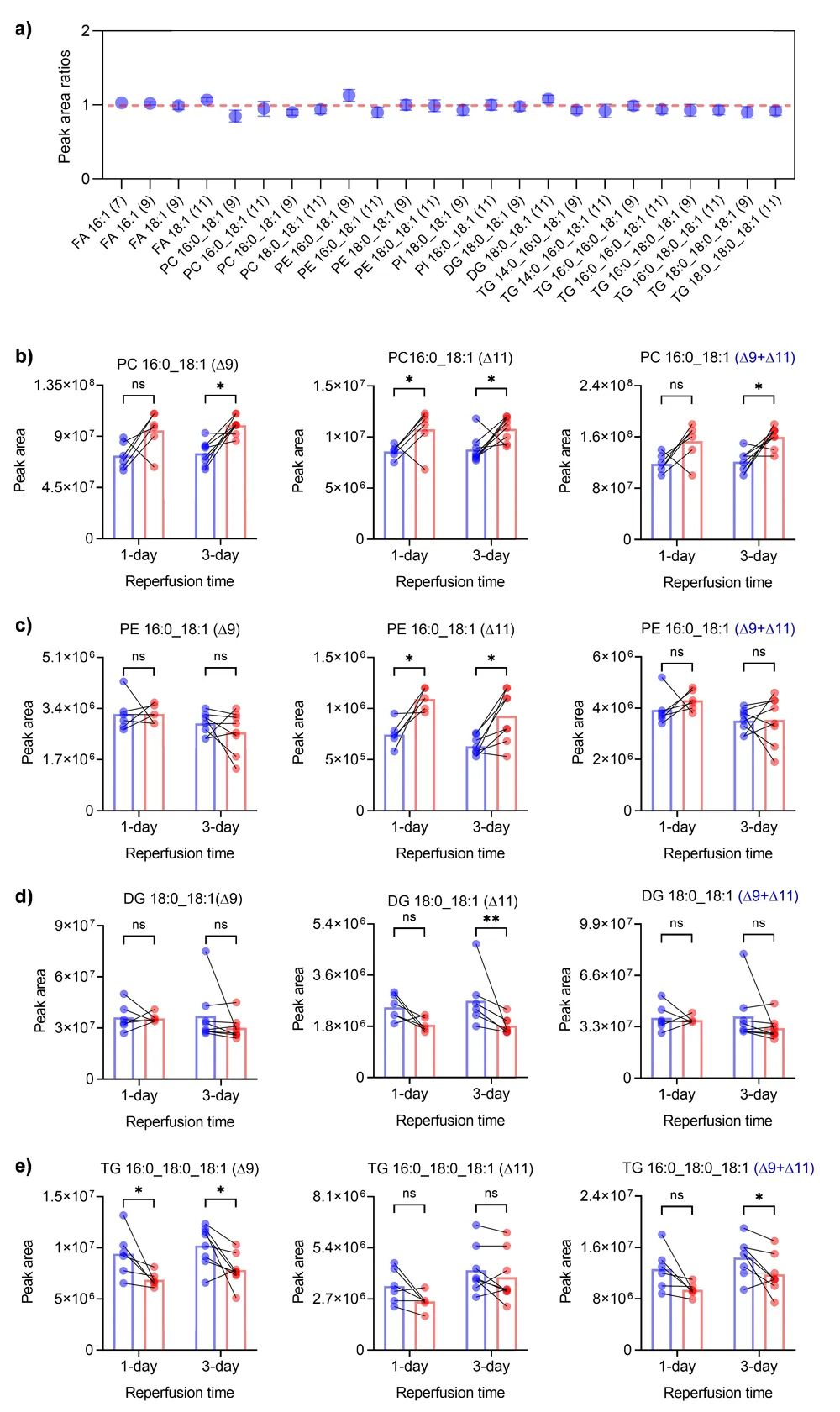
图6. 大脑中动脉闭塞(MCAO)模型小鼠脑组织中不饱和脂质异构体的相对定量。
该工作发表在国际分析化学权威期刊Analytical Chemistry 上,课题组冯桂芳博士为论文的第一作者,陈素明教授为论文的通讯作者,武汉大学为论文的唯一署名单位。该研究得到了国家自然科学基金、国家重点研发计划等项目经费的支持。华中科技大学附属协和医院麻醉科的林云教授为该研究提供了动物模型方面的大力支持。












